Генна інженерія проти гемофілії
Доброго дня! Мене звуть Олександр.
У 2015 році вийшла моя перша науково-популярна книга «Сума Біотехнології. Керівництво по боротьбі з міфами про генетичну модифікацію рослин, тварин і людей». За цю книгу я отримав Премію «Просвітитель». Багато …

Наукові дослідження показали, що вчені редагували геном макака-крильоїда за допомогою методу CRISPR/Cas9, а потім клонирували його, отримавши ще п’ять мавп – у тварин «відключений» ген BMAL1, що відповідає за регуляцію циркадного ритму. Крім демонстрації самої технології клонування …

Вчені із шотландського Рослінського інституту, де було створено перше клоноване ссавець, вівцю Доллі, планують за допомогою методу генетичного редагування CRISPR відредагувати геном курки так, щоб птах була невразлива до грипу. Першого курчати …
 Ми з Віталієм Краусом з Лабораторії наукових відео зробили ремейк класичної лекції про безпеку ГМО. З гарною якістю зйомок, звуку і повноцінним хронометражем. Це та лекція, яку варто кидати своїм друзям, якщо вони все ще бояться генної інженерії. Приємного перегляду.
Ми з Віталієм Краусом з Лабораторії наукових відео зробили ремейк класичної лекції про безпеку ГМО. З гарною якістю зйомок, звуку і повноцінним хронометражем. Це та лекція, яку варто кидати своїм друзям, якщо вони все ще бояться генної інженерії. Приємного перегляду.
Зображення: yourgenome Гемофілія А – спадкове захворювання, що вражає в середньому одного з 5000 чоловіків. Через вроджену мутацію X-хромосоми у таких пацієнтів розвивається дефіцит VIII фактора згортання крові, що проявляється частими кровотечами. До недавнього часу єдиними …
 Сьогодні 14 січня, а значить настав день любові до ГМО! Все ставлять хештег #ЯлюблюГМО і пишуть, чому воно потрібно, важливо і не страшно.Трі події в різних частинах світу відбулися в один день рівно два роки тому.
Сьогодні 14 січня, а значить настав день любові до ГМО! Все ставлять хештег #ЯлюблюГМО і пишуть, чому воно потрібно, важливо і не страшно.Трі події в різних частинах світу відбулися в один день рівно два роки тому.
В Італії було виявлено, що противники ГМО підробили фотографії …

Мені прислали посилання на великий паблік, вкинувши на велику аудиторію черговий набір старих добрих міфів про ГМО. Всі ці міфи я докладно розбирав у своїй книзі «Сума біотехнології». Тому наведу [сильно] скорочену версію однієї з глав. Тут і про алергії, і про суїцид фермерів, і про …

Завершився головний міжнародний конкурс по синтетичній біології та генної інженерії – International Genetically Engineered Machine Competition (iGEM). Щорічно в ньому змагаються команди університетів з усього світу. У 2017-му змагалися майже триста команд: тільки від Китаю заявилися 74 …
 Все-таки генна інженерія поки не дає можливості створювати людей з «заданими характеристиками». Та й здібності людей залежать не тільки від генів, а й середовища.
Все-таки генна інженерія поки не дає можливості створювати людей з «заданими характеристиками». Та й здібності людей залежать не тільки від генів, а й середовища.
«Безстрашні» люди існують. Наприклад, при захворюванні Урбаха – Віті. Це спадкове захворювання, що веде до руйнувань …
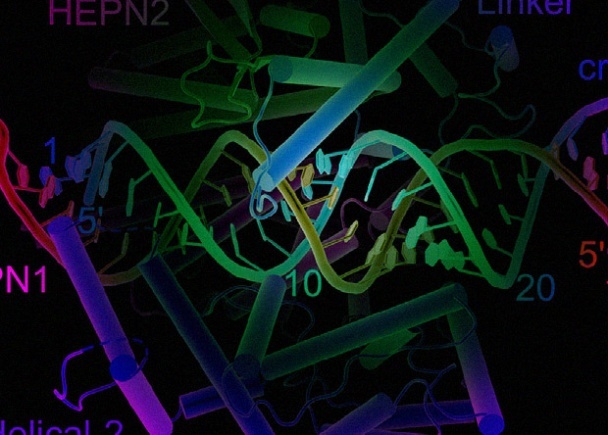
Комплекс білка Cas13 з РНК Liang Liu et al / Cell 2017 Нещодавно відкритий білок Cas13a – компонент системи CRISPR/Cas, який здатний цілеспрямовано руйнувати молекули РНК – змусили працювати в клітинах людини. Вчені з Массачусетського технологічного інституту показали, що за допомогою …

Що таке ГМО? І чому його всі бояться? Як зробити з допомогою «страшного» ГМО козу-павука, лікарські препарати і чому всі ми є ГМО своїх предків.
Управління з контролю за продуктами харчування і лікарськими засобами США (Food and Drug Administration, FDA) офіційно схвалило терапію геномодифікованими лімфоцитами (CAR-T) для лікування лейкемії. Це перший випадок виходу подібного препарату на ринок в США.
Редагування генів дозволило звернути негативний вплив генетичних мутацій на підвищення врожайності. Фото Cold Spring Harbor Laboratory. Кожен раз при виявленні нового корисного ознаки селекціонери намагаються додати його до цінних сортів рослин через схрещування. Але …
Симптоми захворювання у собак не виявлялися протягом двох років після отримання лише однієї ін’єкції. Ілюстрація ColiN00B / pixabay.com. Дослідники застосували технологію редагування генома, щоб усунути симптоми захворювання у собак з м’язовою дистрофією Дюшенна (це генетична …

У лікарів з м. Берлін паніка! Ця штука відновлює суглоби в будь-якому віці. Рецепт: 1 …

Клонування собак завжди вважалося найскладнішим процесом, незважаючи на численні успіхи з іншими ссавцями. Фото SinoGene. В лабораторії приватної біотехнологічної компанії SinoGene народилася клонована з соматичної клітини собака породи бігль по …
Дослідники з США та Південної Кореї вперше в світі видалили з ДНК людського ембріона ген з мутацією, яка відповідає за розвиток захворювання, і замінили його на вихідний. Використовуючи інструмент редагування генома CRISPR/Cas9, дослідники змогли вирізати ген з мутацією, що викликає гіпертрофічну …
Ембріони на ранніх стадіях розвитку. Технологія, що дозволяє змінювати гени людського ембріона, була вперше використана в США. Про це повідомляється в звіті Орегонського університету здоров’я і науки (Oregon Health and Science University, OHSU), на базі якого проводилося дослідження. За …
Simone Brandt / Global Look Press Як «тепловізори» змій допомагають нейрофізіологам, навіщо вчені нагрівають контейнери з дрозофілами і як винахід радянських фізиків допомагає нейровченим, в інтерв’ю Indicator.Ru розповів професор РАН Всеволод Білоусов. Співробітники Інституту біоорганічної хімії …
Гемофілія і генна терапія: перші перемоги

Всесвітній день гемофілії. Традиційно ми згадуємо, що це за хвороба і як далеко просунулася наука в боротьбі з нею. MedAboutMe розбирався в досягненнях генної терапії для лікування гемофілії.

Ця рідкісна хвороба призводить до порушень згортання крові. В результаті гемофіліки можуть загинути від незначної травми через важке крововиливу в мозок або інші органи.
Гемофілія – спадкове захворювання, тому їм не можна заразитися. Більш того, воно зчеплене з підлогою. Ген, мутація якого відповідає за гемофілію, розташований на Х-хромосомі. У дівчаток хвороба не проявляється, тому що у них є друга, здорова хромосома.
А ось у хлопчиків такої «страховки» немає, тому гемофілія – це хвороба представників сильної статі. Додамо, що медицині відомі кілька випадків, коли у дівчаток «поламаними» виявлялися обидві Х-хромосоми – тоді хвороба проявлялася і у них.
Але для такої рідкісної хвороби це – винятковий випадок.
Гемофілія – дуже дорога хвороба. Пацієнти змушені постійно приймати дорогі препарати, тому в більшості країн світу лікування хворих на гемофілію оплачує держава. У нашій країні ця хвороба входить в програму «7 нозологій», завдяки чому люди, хворі на гемофілію, мають шанс прожити повноцінне життя, якщо дотримуються правил прийому ліків.
Як відомо, згортання крові – це досить складний процес, в якому задіяно більше десятка різних факторів згортання крові, які мають позначення від I до XIII. Гемофілія розвивається при:
- дефіциті фактора VIII – гемофілія А,
- дефіциті фактора IX – гемофілія В.
Обидва ці фактори, VIII і IX, зчеплені з Х-хромосомою.
А є ще таке захворювання, яке пов’язане з нестачею фактора Віллебранда – воно так і називається: «хвороба Віллебранда», а також хвороба, викликана дефіцитом фактора XI – раніше її називали гемофілією С.
Але в цих двох останніх випадках гени, що кодують фактори згортання, розташовані не на Х-хромосомі, тому на гемофілію в прямому сенсі слова дані патології не є.
Слід додати, що мутації генів, що кодують ці життєво важливі чинники, теж бувають різні. Для нормального згортання крові необхідно, щоб вміст у крові факторів VIII і IX становило від 50 до 200% від середнього показника. Виділяють кілька ступенів тяжкості захворювання:
- Важка форма: концентрація факторів VIII і IX в крові менше 1%.
- Середня форма: концентрація факторів – від 1 до 5%.
- Легка форма: концентрація факторів – від 6 до 30%. Дана форма гемофілії може довго не виявлятися.
Сьогодні гемофілію «лікують», а точніше, підтримують хворого тим, що йому вводять відсутні фактори згортання крові. Справжнім же лікуванням стане генна терапія, яка дозволить виправити «поломку» гена.
В ході генної терапії в організм пацієнта вводять відсутній правильний ген. Транспортом для нього служить вірус, який модифікований таким чином, щоб не викликати хворобу, а перенести ген і вбудувати його в ДНК клітин печінки.
У разі генів, що кодують фактори гемофілії, використовують зазвичай аденоассоційовані віруси – невеликі безпечні для людини організми.
Якщо терапія проходить успішно, клітини починають виробляти відсутній фактор, а людина отримує можливість відмовитися від прийому ліків.
Вчені обережно говорять про успіхи. Справа в тому, що в ході експериментів на мишах виявилося, що перенесення гена, що кодує фактор VIII, може призводити до розвитку достатньо серйозного ускладнення.
Йдеться про аутоімунному відповіді організму пацієнта на введення чужого гена. При цьому виробництво потрібного білка блокується.
Тепер дослідники шукають шляхи зниження імунної реакції організму, а також намагаються зрозуміти, чому в одних організмах така реакція можлива, а інші піддаються генній терапії без опору.
І в грудні ж минулого року прийшло ще одне надихаюче повідомлення – цього разу про генну терапію гемофілії В.
У дослідженні, що проходив в Children’s Hospital of Philadelphia, брали участь 10 чоловіків з гемофілією В. Їм ввели ген, що кодує білок Factor IX-Padua (FIX-Padua) – це більш активна різновид фактора IX. Препарат був розроблений компанією Spark Therapeutics.
Через рік після єдиної внутрішньовенної ін’єкції концентрація раніше дефіцитного фактора згортання крові у них склала 33%, що, як ми пам’ятаємо, вже не вважається навіть легким ступенем хвороби.
Якщо до лікування епізоди кровотеч відзначалися у них, як мінімум, раз на місяць, то після лікування вони скоротилися до менш ніж одного випадку за рік.
8 з 10 пацієнтів на сьогоднішній день більше не мають потреби в постійному прийомі ліків, що містять відсутній фактор крові, а інші пацієнти перейшли на істотно менше дози препаратів. І ніяких серйозних побічних ефектів.
Проблема поки полягає в тому, що з часом ефект буде зменшуватися. Клітини з новим геном поки не можуть передавати його новим гепатоцитам. Експерименти за участю людей говорять про розрахунковий 8-річний термін дії терапії, а з використанням собак – про 12-річний. Але вчені сподіваються, що в найближчі роки їм все-таки вдасться розробити «одноразове» лікування.
Проблема гемофілії в розвинених країнах та країнах, що розвиваються постійно стає джерелом суперечок між страховими компаніями, пацієнтами та державою через високу вартість лікування. Вартість ліків для одного гемофіліка в США в середньому становить 270 тисяч доларів щорічно, а в окремих випадках ця сума може сягати мільйона.
Генна терапія, з одного боку, набагато дорожча процедура. Але якщо ученим вдасться створити стабільно працюючу технологію, що дозволяє навіть на 8 років скасувати регулярний прийом таблеток, це буде, поза сумнівом, більш вигідним для держави, ніж медикаментозне лікування. Ну, а вже якщо хвороба буде лікуватися назавжди одним-єдиним уколом, то про вигоду навіть говорити не доведеться.
А поки розробки вимагають часу і вкладень. У минулому році наука зробила потужний ривок вперед в області генної терапії гемофілії. Можливо, ще кілька років – і важка спадкова хвороба буде лікуватися відразу при появі дитини на світ.
Як генна інженерія може змінити майбутнє
Фергюс Уолш, кореспондент Бі-бі-сі в області медицини
 Image caption Так виглядає молекула ДНК. Вчені вважають, що найближчим часом вони зможуть вносити в неї зміни за допомогою технології CRISPR
Image caption Так виглядає молекула ДНК. Вчені вважають, що найближчим часом вони зможуть вносити в неї зміни за допомогою технології CRISPR
Запам’ятайте абревіатуру CRISPR вже сьогодні, тому що завтра вона, найімовірніше, змінить ваше майбутнє.
Технологія CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) вимовляється як «кріспер» і являє собою біологічну систему для зміни ДНК. Технологія ця, відома також як генна інженерія, може змінити майбутнє всієї планети.
Звучить як досить смілива заява, але саме такої думки дотримуються багато провідні світові генетики та біохіміки.
CRISPR була відкрита в 2012 році молекулярним біологом, професором Дженніфер Дудною. Її команда вчених в Університеті Берклі в Каліфорнії вивчала, як бактерії захищаються від вірусної інфекції.
Зараз професор Дудна і її колега Еммануель Шарпентье входять в число найвпливовіших вчених світу. Природний механізм, який вони виявили в ході своїх досліджень, може бути використаний біологами для того, щоб вносити точкові зміни в будь-яку ДНК.
- «З тих пір як ми опублікували своє дослідження чотири роки тому, багато світових лабораторії стали застосовувати цю технологію на тваринах, рослинах, людях, грибах, інших бактеріях – іншими словами, практично на кожному досліджуваному організмі», – розповіла професор в інтерв’ю Бі-бі-сі.
- Коли бактерію атакує вірус, вона виробляє генетичний матеріал, що відповідає генетичній послідовності нападника.
- Цей матеріал в поєднанні з ключовим білком Cas9 може прикріпитися до ДНК вірусу, зламати генетичний код і нейтралізувати вірус.
- Тепер вчені можуть застосовувати цю ж схему, щоб вставляти в ДНК нові елементи, видаляти або виправляти її ділянки.
- Цей процес настільки точний, що вчені можуть перебрати мільярди хімічних комбінацій, складових ДНК клітини, щоб внести в генетичний код якесь конкретне ключове зміна.
Важливо і те, що це простий і недорогий метод. Тому він прискорить всі види досліджень – від створення генетично модифікованих моделей людських хвороб у тварин до пошуку мутацій ДНК, які провокують виникнення захворювань або, навпаки, захищають від них.
Коли і як ми зможемо почати відчувати на собі наслідки лікування із застосуванням CRISPR? З огляду на, що цієї технології всього лише кілька років, не дивно, що випробування її на пацієнтах ще не почалися, проте деякі експерименти вже знаходяться на стадії планування.
Бостонська біотехнологічна фірма Editas Medicine планує запустити клінічні випробування першого генномодифікуючого ліки до 2017 року. Передбачається, що за його допомогою можна буде лікувати сліпоту Лебера (LCA10) – рідкісне захворювання сітківки ока, яке призводить до сліпоти, так як в результаті мутації генів відбувається поступова втрата розташованих в оці фоторецепторів.
Мета – лікування раку
В області біотехнологій існує відразу кілька недавно створених фірм, які сподіваються впровадити застосування технології CRISPR в лікарнях.
Вони припускають, що «кріспери» можуть бути використані для посилення функцій Т-клітин організму, що може поліпшити здатність імунної системи розпізнавати ракові клітини і боротися з ними. Ще одна потенційна область застосування технології – лікування захворювань крові та імунної системи.
Правовласник ілюстрації SPL Image caption За допомогою CRISPR вчені зможуть втручатися в ДНК
Лише одне затьмарює майбутнє CRISPR – боротьба за патент на технологію. З одного боку, на нього претендує команда професора Дудни, з іншого – група вчених з Бостона.
Це навряд чи зупинить дослідників у застосуванні «крісперов», але може серйозно вплинути на те, хто отримає фінансову вигоду від нової технології.
Дві попередні технології генної інженерії вже застосовуються на практиці.
Одна з них – TALENs – була використана в лондонській лікарні Грейт-Ормонд-стріт для успішного лікування раку. У пацієнтки Лайли Річардс була агресивна форма лейкемії, і їй не допомагало ніяке лікування. На сьогоднішній день Річардс залишається першим і єдиним чоловіком, чиє життя було врятоване за допомогою редагування генома.
Перші в світі випробування генної інженерії відбувалися в Каліфорнії з використанням іншої технології – ZFNs.
Тоді імунні клітини були вилучені з крові близько 80 пацієнтів з ВІЛ. Потім вчені видалили ген під назвою CCR5, який ВІЛ-інфекція використовує для доступу до клітин.
- Лікування було засновано на рідкісній генетичній мутації, яка дає людям природний імунітет до захворювання.
- Одним з волонтерів у тому дослідженні був Метт Чаппелль, який прожив з вірусом більшу частину дорослого життя і мав можливість спостерігати той страхітливий ефект, який ВІЛ і СНІД справили на гей-співтовариство Сан-Франциско.
- З тих пір як ген його імунних клітин був відредагований, Чаппелль вже два роки не користується антиретровірусними препаратами.
- Незважаючи на те, що ці дослідження були лише невеликими і експериментальними, а отже, до їх результатів потрібно ставитися з певною часткою обережності, проте їх результати виглядають багатообіцяюче.
- Генетичні ліки проти ВІЛ було випробувано фірмою Sangamo Biosciences, яка володіє ексклюзивною ліцензією на технологію ZFN.
Правовласник ілюстрації RIA Novosti Image caption Науці відомі випадки лікування від ВІЛ за допомогою генної інженерії
Компанія збирається почати випробування на пацієнтах з гемофілією – серйозним захворюванням, пов’язаним з порушенням згортання крові, – а також вже працює над лікуванням бета-таласемії.
Найбільш спірне питання в редагуванні генома – це внесення змін до зародкову лінію клітин людини, тобто тих генів, які будуть передаватися з покоління в покоління.
Теоретично можна було б змінювати ДНК ембріонів, які несуть в собі ген хвороби Хантінгтона або муковісцидозу. Однак в такому випадку можна говорити і про проведення інших генетичних «поліпшень», що фактично може призвести до «генетичного проектування» немовлят.
Генна інженерія та ембріони
Ніхто з учених не пропонує (принаймні, поки) «виробництво» генетично модифікованих немовлят. Однак кілька груп китайських вчених вже провели деякі базові дослідження в цій області, а Великобританія стала першою країною, яка формально дозволила генну модифікацію людських ембріонів – виключно в наукових цілях.
Дослідження будуть проходити в лондонському інституті Френсіса Кріка, який відкриється через кілька місяців. Там буде знаходитися найбільша біомедична лабораторія в Європі і центр генної інженерії.
Правовласник ілюстрації Science Photo Library Image caption Генетична модифікація ембріонів людини може допомогти значно поліпшити процедуру штучного запліднення
Команда під керівництвом Кеті Ніакан, яка нещодавно увійшла в список з 100 найвпливовіших людей світу за версією журналу Time, буде використовувати CRISPR для редагування основних генів ембріона, щоб виявити генетичні помилки, що призводять до повторюваних викиднів. В рамках дослідження ембріонам дадуть розвиватися лише кілька днів.
«Я сподіваюся, що це дозволить нам більш точно розібратися в механізмах раннього розвитку людини. Я думаю, що це також допоможе з’ясувати, як ми можемо покращити технологію екстракорпорального запліднення і зрозуміти, які ембріони з більшою ймовірністю продовжать розвиватися та приведуть до народження здорових дітей», – сказала в розмові з Бі-бі-сі Кеті Ніакан.
Етична сторона
Однак ці дослідження викликають етичні питання у Марсі Дарновскі з Центру генетики і суспільства в Сан-Франциско.
На її думку, генетична модифікація людських ембріонів при недостатньому контролі призведе до того, що рано чи пізно в одній з лабораторій буде створений перший генетично модифікований немовля.
«Знайдуться багаті батьки, які захочуть придбати для свого потомства останній «апгрейд». Цілком можливо, що люди розділяться на тих, хто може дозволити собі «поліпшити» своє потомство, і тих, кому це не по кишені або хто не захоче цього робити. А це призведе до ще більшої нерівності, ніж те, з яким ми вже маємо справу», – вважає Дарновскі.

Багато провідні вчені в цій галузі стурбовані тим, що потенційно технологія може бути використана в інтересах євгеніки, для створення генетичної дискримінації.
У розмові з Бі-бі-сі професор Дудна зізналася, що її мучив жахливий сон. У ньому вона заходила в темну кімнату, в якій спиною до неї сидів чоловік.
- «Коли він повернувся до мене обличчям, я з жахом зрозуміла, що це Гітлер і що він викликав мене, щоб обговорити нову технологію, в використанні якої він дуже зацікавлений», – розповіла професор.
- За словами Дудни, незважаючи на те, що дуже важливо регулювати використання «крісперов», разом з тим необхідно і дійти згоди щодо подальших дій.
- «Я не хочу давати нездійсненних обіцянок, але мені здається, що це допоможе покласти край хворобам – і ми повинні дати шанс вченим і лікарям втілити це в життя», – каже професор.
Генна інженерія в медицині – унікальні технології лікування
Трансплантація органів і тканин – складний, але дуже ефективний інструмент у боротьбі зі смертельно небезпечними захворюваннями.
Численні пересадки серця, печінки, нирок, які продовжили життя тисяч безнадійних, здавалося б, пацієнтів, стали цілком штатними операціями.
Сьогодні хірурги і фізіологи прагнуть розширити сферу можливостей медицини і вивести трансплантологію на принципово новий рівень. Так би мовити, освоїти ті області, про які раніше могли подумати тільки письменники-фантасти.
Про що мова?
Що ж реально дала людству модифікація живих організмів на генетичному рівні? По суті, біотехнологія або генетична інженерія (ГІ) – це сукупність методик, що дозволяють виокремлювати окремі гени з клітин, вводити їх в генотип інших організмів і отримувати рекомбінантні (т. е. розщеплені і зібрані заново) ДНК і РНК. Більш того, розшифровка послідовності амінокислот в білках дозволяє штучно синтезувати необхідні гени з базових нуклеотидів.
Практична складність роботи біотехнологів укладається в оманливе простий алгоритм. Якщо впровадити раніше виділений або «зібраний вручну» ген в ДНК живої клітини, вона почне відтворювати необхідний білок. Це відкриває воістину необмежені можливості.
Хочемо ми того чи ні, генетична модифікація ненав’язливо, але міцно закріпилася в сучасній медицині. Її досить широке поширення пояснюється безцінною можливістю перекроювання реалій під свої потреби.
Перший успіх ГМО
Наслідки такого важкого захворювання, як діабет, відомі у всьому світі. В першу чергу, воно вражає серцево-судинну і нервову системи, що тягне за собою пригнічення всіх функцій організму. Щорічно мільйони людей поповнюють сумну статистику хворих, і єдине, по суті, на що можуть покластися діабетики – це інсулін.
Аж до 80-х років минулого століття препарат проводився за технологією 1925 року – шляхом вилучення гормону з коров’ячої або свинячої підшлункової залози. Такий спосіб виробництва ледве покривав 10% потреб.
З огляду ж на сучасні темпи поширення хвороби, він не впорався б з таким масовим попитом на інсулін навіть із застосуванням напівсинтетичних методик.
Широкодоступний зараз препарат став би критично дефіцитним, якщо б не прорив, здійснений спільними зусиллями вчених з НДІ Бекмана і біотехнологічної корпорації Genentech.
Артур Ріггс і Кейіті Ітакура за участю Герберта Бойера успішно використовували технологію рекомбінантних ДНК для впровадження гена синтезу людського інсуліну в геном бактерій – пекарських дріжджів і кишкової палички. Клітини отриманих в результаті експерименту генетично модифікованих бактерій успішно росли, ділилися і в результаті своєї життєдіяльності виробляли інсулін, ідентичний людському.
Синтетичний людський інсулін став першим схваленим для використання ліком, отриманим шляхом генної інженерії.
До цього дня він вважається одним з кращих препаратів, що підтримують життя діабетиків по всьому світу, а випробувана при його створенні технологія міцно увійшла в побут фармацевтичних підприємств.
Уже кількість ліків, отриманих аналогічним шляхом, перевалило за сотню і продовжує рости.
В останні десятиліття уряди багатьох країн дали добро на розробку інноваційних вакцин.
Причини розв’язання рук дослідників на державному рівні цілком зрозумілі: катастрофічне поширення стійких до антибіотиків мікроорганізмів, зростання числа хворих тими інфекціями, з якими раніше вдавалося успішно справлятися, банальна відсутність ефективних вакцин проти туберкульозу, СНІДу та малярії …
Для боротьби з цією напастю створюються рекомбінантні вакцини. Таким способом вже вдалося отримати ефективні вакцини проти гепатиту В і вірусу папіломи людини.
Для створення щеплень методами генної інженерії з ДНК патогенного організму виділяється ген, який кодує продукцію, що викликає імунну реакцію білка, після чого ген вбудовується в плазміду, стабільну молекулу ДНК нейтрального мікроорганізму, наприклад дріжджовий бактерії.
Готовий антиген вводять в культуру для подальшого самокопіювання шляхом клітинного поділу, після чого молекулу знову виділяють, очищають і використовують в якості вакцини. Простіше кажучи, всі ці маніпуляції дозволяють отримати білки, безпечні для людини, але при цьому викликають такий же імунну відповідь, як і хвороботворний гість.
Потрапляючи в організм, модифікована молекула запускає в клітинах тіла синтез чужорідних протеїнів, які можуть бути розпізнані імунною системою і нейтралізовані.
На жаль, більшість подібних препаратів поки що мають недостатню імуногенність, але роботи по виправленню цього недоліку ведуться невпинно.
Зцілення на генетичному рівні
Наступною сходинкою еволюції біотехнологій в медицині стала генотерапія, хоча її методи поки знаходяться на стадії експериментальних розробок. В її основі лежить ідея про корекцію спадкових і набутих генетичних недоліків живого організму.
Найважливіша проблема, яка перешкоджає впровадженню генної терапії в медичну практику – забезпечення ефективної трансфекції, доставки генів до клітин- «мішенях». Найбільш перспективними вважаються методики транспортування вбудованої в плазміду модифікованої ДНК або молекули в складі неонкогенних вірусних частинок.
Погодьтеся, подібні задуми звичніше бачити на сторінках науково-фантастичних романів. Проте майбутнє планує наступити раніше, ніж може здатися.
Експертна рада американського Управління з контролю продуктів харчування і ліків (FDA) одноголосно схвалила генну терапію гострого лімфобластного лейкозу дітей і дорослих до 25 років, розроблену групою вчених з університету Пенсільванії і компанії Novartis.
За допомогою модифікованого вірусу імунодефіциту в власні Т-лімфоцити пацієнта впроваджується ген, що допомагає розпізнавати і знищувати злоякісні клітини. Звучить неймовірно, але ВІЛ в буквальному сенсі «вчить» клітини організму боротися з раком!
Правда, препарат, випущений на ринок під назвою Kymriah, ще далеко не досконалий.
Через низку небезпечних побічних дій його можна застосовувати тільки в клініках під наглядом лікарів, які пройшли спеціальну підготовку.
Хоча той факт, що під час випробувань у 83% пацієнтів з гострим лейкозом наступила ремісія, дозволяє зважити на цей ризик із оптимізмом.
Надалі генна терапія зможе застосовуватися для виправлення дефектів центральної нервової системи, захворювань серця і судин, гемофілії, корекції імунної відповіді (в т. ч. ВІЛ) і навіть мутацій генома.
Значення ГІ для медицини
Деяким гематологічним, кардіологічним, ендокринологічним і противірусним лікам життєво необхідно максимально відповідати природним аналогам в людському організмі. В цьому плані синтетичні препарати мають ряд незаперечних переваг.
По-перше, на відміну від ліків, одержуваних з секреції тварин, вони аналогічні людським за структурою. По-друге, генна модифікація в фармацевтиці дозволила відмовитися від специфічного сировини, як, наприклад, гіпофізи трупів або сечі жінок в менопаузі.
І по-третє, вирішальним фактором нерідко виявляється дешевизна і раціональність виробництва.
Для виробництва 200 грамів очищеного порошку інсуліну необхідно 1000 літрів живильного середовища, населеної генетично модифікованими бактеріями, або 6000 корів, з чиїх підшлункової залоз витягнуть цінний гормон.
Коли питання постає таким «ребром», тисячі піддослідних тварин, принесених в жертву прогресу, здаються найменшим злом.
Незважаючи на помітні успіхи, медична генна інженерія залишається областю, яку вчені тільки починають освоювати.
Як і раніше залишається маса чисто технологічних труднощів, не кажучи вже про недосконалість способів подолання імунної реакції організму і ризику зараження при використанні модифікованих вірусів. Проте перспективи світлого майбутнього змушують наполегливих дослідників без жалю поступатися принципами і страхами.
Підтримайте проект Світ Знань, підпишіться на наш канал в Яндекс Дзен
Генотерапія гемофілії: новий вектор – нові успіхи
Багаторічне дослідження, проведене під керівництвом доктора Тімоті Ніколаса з університету Північної Кароліни і доктора Луїджі Налдіні з інституту генної терапії Сан-Рафаеля, продемонструвало безпеку і ефективність нового методу генної терапії гемофілії В.
Гемофілія – це спадкове захворювання, що викликає неконтрольовані кровотечі, нерідко закінчуючи ранньою загибеллю пацієнтів.
При гемофілії А, частота народження якої становить приблизно 1 випадок на 5 000 немовлят чоловічої статі, печінка не забезпечує синтез достатньої кількості фактора згортання крові VIII. При гемофілії В, яка виявляється у 1 з 35 000 немовлят чоловічої статі, в організмі відсутній фактор згортання крові IX.
Протягом усього життя пацієнтам з гемофілією доводиться робити регулярні (до декількох разів на тиждень) ін’єкції відповідних факторів згортання крові, однак це не забезпечує повного захисту від кровотеч.
Генна терапія здатна радикально змінити ситуацію, так як вона має на увазі одноразове введення в організм терапевтичного гена, який забезпечить стабільний синтез відсутнього білка протягом тривалого часу.
Найчастіше для розробки геннотерапевтичних препаратів використовуються аденовірусні вектори.
Однак при відборі пацієнтів для клінічних досліджень за допомогою таких векторів приблизно у 40% потенційних учасників виявлялися антитіла до аденовірусу, що робило їх несприйнятливими до лікування.
Автори пропонують вирішити цю проблему за допомогою розробленого ними альтернативного вектора, що представляє собою модифікований лентивірус, що належить до сімейства ретровірусів.
Вони видалили з геному вірусу гени, що відповідають за його реплікацію, що не позбавило вірус здатність проникати в організм, але зробило його абсолютно нешкідливим для людини.
При цьому переважна більшість людей не має антитіл до лентивірусу, що мінімізує ймовірність зниження ефективності терапії через нейтралізації вірусних векторів імунною системою.
(Ми недавно писали про успіх клінічних досліджень на перших 10 добровольцях генотерапії гемофілії В з використанням ще одного вектора – аденоасоційованого вірусу).
Ще одна перевага нового лентівірусного вектора полягає в його великому розмірі і, відповідно, здатності переносити велику кількість генетичного матеріалу.
В даному випадку – досить великий ген, що кодує фактор згортання крові IX.
(Цей підхід може використовуватися і для лікування гемофілії А, незважаючи на ще більші обміни гена, що кодує фактор згортання крові VIII.)
Несучі терапевтичний ген фактора згортання крові IX лентівірусні вектори ввели трьом собакам з гемофілією В безпосередньо в печінку або внутрішньовенно.
До терапії у собак у середньому розвивалося 5 спонтанних кровотеч на рік, які потребували лікування в умовах клініки. Через понад три роки після проведення терапії частота спонтанних кровотеч у тварин знизилася до 0-1 разу на рік.
При цьому ні у одного з тварин не було зареєстровано небажаних побічних ефектів.
Для подальшого підтвердження безпеки підходу дослідники провели експерименти на трьох лініях мишей з високою схильністю до розвитку ускладнень, таких як формування злоякісних пухлин, при встановленні в їх геном чужорідної ДНК. Незважаючи на схильність, ні в одному з експериментів у мишей не було зареєстровано ніяких несприятливих побічних ефектів.
Незважаючи на вражаючі результати експериментів на тваринах, автори визнають, що до проведення клінічних досліджень ще належить виконати чимало роботи. Зокрема, вони планують підвищити ефективність терапії.
До терапії фактор згортання крові IX взагалі не реєструвався в організмі піддослідних собак, тоді як після терапії продукція цього білка в печінці тварин становила 1-3% від нормального показника.
Цього було достатньо для значного зменшення ризику розвитку спонтанних кровотеч.
Однак дослідники відзначають, що їм хотілося б удосконалити розроблений підхід таким чином, щоб він забезпечував збільшення продукції фактора згортання крові IX до 5-10% від нормального рівня зі збереженням безпеки для пацієнта.
Генна медицина
Єгор Баторія про магію генної інженерії
Людина – це проміжна ланка еволюції, необхідне для створення вінця творіння природи – чарки коньяку та часточки лимона.
Стругацькі “Понеділок починається в суботу»
Череда воістину великих досягнень в області генетики, молекулярної біології і вірусології пов’язує між собою літри життєво необхідного інсуліну і сою в ковбасі, повсякденний «ІФА на сифіліс» і майбутні сади на Марсі. Суто теоретичні знання про структуру ДНК та лігази-рестриктази обернулися в недалекому минулому цілком практичною генетичною інженерією. Отримані з її допомогою продукти можуть прикро називатися «генетично модифікованими» і коштувати значно дешевше на полиці в супермаркеті або гордо називатися «рекомбінантними» і бути заслужено дорогими, перебуваючи в аптеці. Подальший розвиток генної інженерії, за різними прогнозами, може привести як до довгого щасливого життя без голоду і хвороб, так і до зомбі-апокаліпсису в результаті втечі інфікованої мавпи від догляду, нарешті, вчених.
Сутність питання
Генетична (генна) інженерія – сукупність прийомів, методів і технологій, які дозволяють:
- отримувати рекомбінантні РНК і ДНК;
- виділяти гени з організму (клітин);
- здійснювати маніпуляції з генами і вводити їх в інші організми.
Властивості будь-якого організму (колір пелюсток/вовни/волосся, здатність засвоювати глюкозу, можливість вирости до 2 метрів тощо) залежать від білків. Білки кодуються певними генами.
Ген можна «вирізати» з ДНК будь-якого організму ферментами або, знаючи послідовність амінокислот в потрібному білку, зібрати ген цього білка з окремих нуклеотидів, потім «вставити» його в ДНК бактерії (рослини, тварини), яка почне виробляти заданий білок.
За уявною простотою – десятиліття наукового пошуку, відмічені кількома Нобелівськими преміями.
- Для тих, хто забув
- Вектор – молекула ДНК або РНК, здатна переносити включені в неї чужорідні гени в клітину.
- Лігази – ферменти бактерій і вірусів, які з’єднують кінці двох фрагментів ДНК.
Плазміда – позахромосомна молекула ДНК бактерій або дріжджів, як правило, кільцева, здатна до автономної реплікації. У генної інженерії використовується як вектор.
Рестріктази – ферменти бактерій, які розпізнають і атакують певні послідовності нуклеотидів в ДНК. У генної інженерії рестріктази «вирізають» фрагменти з молекули ДНК вектора, що дозволяє вставити на місце, що звільнилося потрібний ген.
Значення генної інженерії для медицини
Продукти генної інженерії увійшли в медичну практику: ліки для лікування рідкісних хвороб, рекомбінантний інсулін, вакцини проти вірусу гепатиту В – без них сучасному лікарю важко уявити собі світ.
Генно-інженерними методами виробляють деякі високоселективні алергени для шкірних проб, деякі реагенти для імуноферментного аналізу та багато іншого. На етапі доклінічних випробувань медикаментів приносяться в жертву мільйони генетично змінених тварин.
Нижче в порядку ускладнення технології і ступеня відриву від реальності представлені основні приклади застосування генної інженерії в медицині.
Ліки з бактерій
Сьогодні на озброєнні у лікарів є ряд препаратів, для яких критично важливо точне відповідність аналогам в організмі.
Це препарати замісної терапії при ендокринологічних захворюваннях, гематологічних хворобах (еритропоетин, гранулоцитарний колонієстимулюючий фактор, фактори згортання крові, деякі моноклональні антитіла тощо), вірусних інфекціях (інтерферони), інфаркті міокарда, ішемічному інсульті (фібринолітики) і багатьох інших.
Методи генної інженерії мають наступні переваги при отриманні такого роду ліків:
- Ідентичність речовин за структурою людським. Інсулін, що вироблявся з підшлункової залози свиней та великої рогатої худоби, відрізнявся від людського по одній і трьом амінокислотам, що часто призводило до небажаних реакцій.
- Більш низька ціна і зручне виробництво. Для отримання 200 г сухої речовини того ж інсуліну потрібно підшлункова залоза від більш ніж 6000 корів (або свиней). Те ж кількість може бути вироблено бактеріями з 1000 л культуральної рідини.
- Відмова від специфічного сировини, яке повністю не очищається, наприклад, гіпофізи трупів використовувалися для отримання соматотропного гормону, а сеча жінок в менопаузі – традиційне джерело фоллікулостимулюючого і лютеїнізуючого гормонів.
Ліки з флори і фауни
Бактерії і дріжджі, культури клітин яєчника китайського хом’яка і моркви, які продукують сировину для препаратів, – це добре, але досить дорого, до того ж збирання деяких складних молекул тим же бактеріям недоступна через біохімічні відмінності з людиною. Ідея перекладу «біореакторів» на підніжний корм або добрива давно витала в повітрі.
Механізм в цілому той же: потрібний ген вбудовується в ДНК тварини або рослини. ДНК мікроін’єкції вводиться в ядро заплідненої яйцеклітини, яка імплантується в матку. Більшість ембріонів, звичайно, гине, а серед народжених тварин далеко не всі виробляють потрібну речовину.
Проте на сьогоднішній день ми маємо трансгенних корів, кіз, свиней, кролів, курей, лососів і шовкопряда.
З їх біологічних рідин в експериментах отримані людські α-антитрипсин, альбумін, гемоглобін, еритропоетин, гормони, фактори згортання крові, шовний та перев’язочний матеріал. Чи варто було заради свинячого сперми відходити від жіночої сечі, поки не ясно, адже складності з очищенням зберігаються, та й ціна цих препаратів з урахуванням технологічного процесу все ще буде дуже високою.
Рослини-біореактори зручні тим, що позбавлені хвороб ссавців, як правило, швидше ростуть, простіше і дешевше в розведенні та зберіганні врожаю. Асортимент трансгенної флори не поступиться нашим ринкам в кінці літа: від огірків з соняшниками до полуниці і ківі.
«Улюблена» ж зелень генних інженерів-фармакологів – це тютюн, соя, картопля, рис і кукурудза.
Набір можливих ліків приблизно відповідає «твариною»: гормони, гемоглобін, білки крові, моноклональні антитіла для діагностики та лікування онкології і вірусних інфекцій, інтерферон, а також антигени вірусів і бактерій – потенційні вакцини. Жодного препарату поки не зареєстровано.
Плодові вакцини
Логічне продовження трансгенних рослин – так звані їстівні ліки (в основному вакцини).
Справді, навіщо витрачати час і кошти на виділення білків холерного вібріона, малярійного плазмодія, вірусів гепатиту В, сказу і імунодефіциту людини з томатів, бананів і картоплі, якщо їх можна з’їсти і так? По крайней мере, в дослідах на мишах вдається досягти розвитку імунної відповіді, і навіть термічна обробка в ряді випадків не знижує ефективності їстівної вакцини. Антигени в кишечнику «зустрічаються» з антигенпрезентуючими клітинами, далі все, як завжди. Переваги очевидні: дуже дешево, смачно і в великій кількості. Основні недоліки: можливість розвитку імунологічної толерантності замість імунної відповіді, варіабельність вмісту цікавить білка від плоду до плоду навіть з одного куща, і в підсумку – неясність «дозування».
Вакцини
«Австралійський антиген», білок оболонки вірусу гепатиту В і капсидні білки декількох типів вірусу папіломи людини для відповідних вакцин продукують трансгенні дріжджі. Принцип той же, що і з інсуліном, тільки замість людського синтезується вірусний білок.
Цим же шляхом йдуть творці випробовуваної зараз протигрипозної вакцини, в основі якої лежить імуногенний білок клітинної стінки М2, висококонсервативний, на відміну від майже щорічно «оновлюваних» гемаглютиніну і нейрамінідази (тих самих «H» і «N» з порядковими номерами в назві чергового підтипу вірусу).
Також можливе створення вірусних і бактеріальних векторів. При цьому гени високоімуногенних білків вводяться в непатогенні віруси і бактерії, після чого, наприклад, штами шигел починають експресувати антигени малярійного плазмодія, а сальмонели – білки вірусу імунодефіциту людини.
Потрапляючи в організм, такі «вівці в вовчих шкурах» індукують не тільки гуморальний, але і клітинну імунну відповідь.
Особливий плюс подібних «сальмонельних» вакцин – це можливість їх перорального прийому, що значно спростить імунізацію населення і знизить рівень напруженості (і шуму) в прищепних кабінетах дитячих поліклінік.
Найважливішим успіхом генної інженерії в медицині, вінцем імунопрофілактики та перспективним методом лікування пухлин і аутоімунних захворювань вважаються ДНК-вакцини. У плазмиду вбудовують промотор і ген цікавого білка (оболонки вірусу, клітинної стінки бактерії, пухлинний антиген).
Отримані вектори тим чи іншим шляхом вводяться в організм і потрапляють в ядро антигенпрезентуючих клітин. У ній продукується чужий білок, який «ріжеться» на короткі пептиди і представляється для розпізнавання клітин імунної системи. Таким чином, роль «біореактора» грають уже клітини організму людини.
Більшість таких вакцин поки володіють недостатньою імуногенністю, ведуться роботи по її підвищенню.
Генна терапія
Подальший розвиток даної галузі науки призвело до появи генної терапії. Тут вже все по-дорослому, хоча поки і експериментально. Усуваються посередники типу бактерій, кіз і бананів.
Як правило, так намагаються лікувати важкі і рідкісні спадкові або спорадичні захворювання, патогенез яких обумовлений дефектом якогось одного гена, наприклад, первинні імунодефіцити.
При цьому інші методи лікування неефективні або важкодоступні, і втрачати, загалом, нічого. Результати вражаючі, але і ціна небажаних реакцій висока.
Ведуться розробки препаратів генної терапії і для більш «народних» хвороб: ішемічної хвороби серця, хронічної критичної ішемії нижніх кінцівок (місцево вводяться гени фактора росту ендотелію судин – з метою стимуляції ангіогенезу), пухлин різної локалізації (блокада онкогенів, індукція апоптозу) і, звичайно, цукрового діабету I типу. Є надія, що вони будуть дешевші.
Загалом, в генній інженерії залишається досить технологічні труднощі, імунологічного невідповідності, небезпеки інфікування людини вірусами тварин з потенційним появою нових хвороб. Всього цього вперті і безпринципні вчені не дуже-то і бояться. Зрозуміло, що у людства вистачить мізків, щоб якось вирішити ці проблеми, залишається сподіватися, що вистачить розуму не наробити нових.
Випробування препаратів генної терапії з різним успіхом проходять при синдромі Віскотта – Олдріха, хронічної гранулематозної хвороби, муковісцидозу, м’язовій дистрофії Дюшенна і Беккера, хвороби Паркінсона, лізосомальних хворобах накопичення. Перше зареєстроване в Європі лікарський засіб генної терапії при рідкісній хворобі гіперхіломікронемії коштує близько 1,6 мільйона гривень на курс.